Suplementacja w PCOS
Odpowiednio dobrana suplementacja może stanowić bardzo dobre uzupełnienie leczenia zespołu policystycznych jajników, jednak tylko wtedy, gdy w pierwszej kolejności zaczniesz od trwałej zmiany stylu życia, którą na czynniki pierwsze rozłożyłam w poprzednim poście dotyczącym PCOS. Jeśli jeszcze nie czytałaś, nic straconego. Tutaj znajdziesz do niego odnośnik! Pamiętaj jednak, że nawet najlepiej dobrana suplementacja nie zastąpi leczenia farmakologicznego ani Twojej pracy nad zmianą stylu życia.
Ważne! Nie wprowadzaj suplementacji na własną rękę - zawsze skonsultuj się z lekarzem. Niewłaściwie dobrana suplementacja może pogorszyć Twój stan zdrowia.
MIO-INOZYTOL
Odnotowano także pojawienie się regularnych cykli miesiączkowych, znacznie częstsze występowanie cykli owulacyjnych, zarówno u kobiet o prawidłowej masie ciała jak i z nadmierną masą ciała, obniżenie objętości jajników, zwiększenie stężenia progesteronu w fazie lutealnej cyklu (faza pomiędzy owulacją a pierwszym dniem krwawienia miesiączkowego), obniżenie stężenia androgenów: testosteronu i DHEA (dehydroepiandrosteronu) [4].
Co więcej kobiety stosujące mio-inozytol zaobserwowały zmniejszenie nasilenia nadmiernego owłosienia (hirsutyzmu), obniżenie ciśnienia tętniczego oraz poprawę parametrów gospodarki lipidowej (cholesterolowej) [4].
Podsumowując, suplementacja mio-inozytolem wpływa na:
- zmniejszenie insulinooporności: poprawę tolerancji glukozy, zwiększenie wrażliwości na insulinę, obniżenie wskaźnika HOMA
- poprawę procesu dojrzewania komórek jajowych,
- obniżenie stężenia hormonu luteinizującego (LH) i prolaktyny oraz zmniejszenie stosunku LH do FSH (hormon folikulotropowy)
- uregulowanie cykli miesiączkowych, częstsze cykle owulacyjne
- zmniejszenie objętości jajników,
- zwiększenie stężenia progesteronu w fazie lutealnej cyklu,
- obniżenie stężenia męskich hormonów płciowych (androgenów, takich jak testosteron i DHEA),
- zmniejszenie nasilenia nadmiernego owłosienia,
- poprawa funkcji układu krążenia i zmniejszenie ryzyka sercowo-naczyniowego poprzez obniżenie ciśnienia tętniczego i poprawę parametrów gospodarki lipidowej (cholesterolowej).
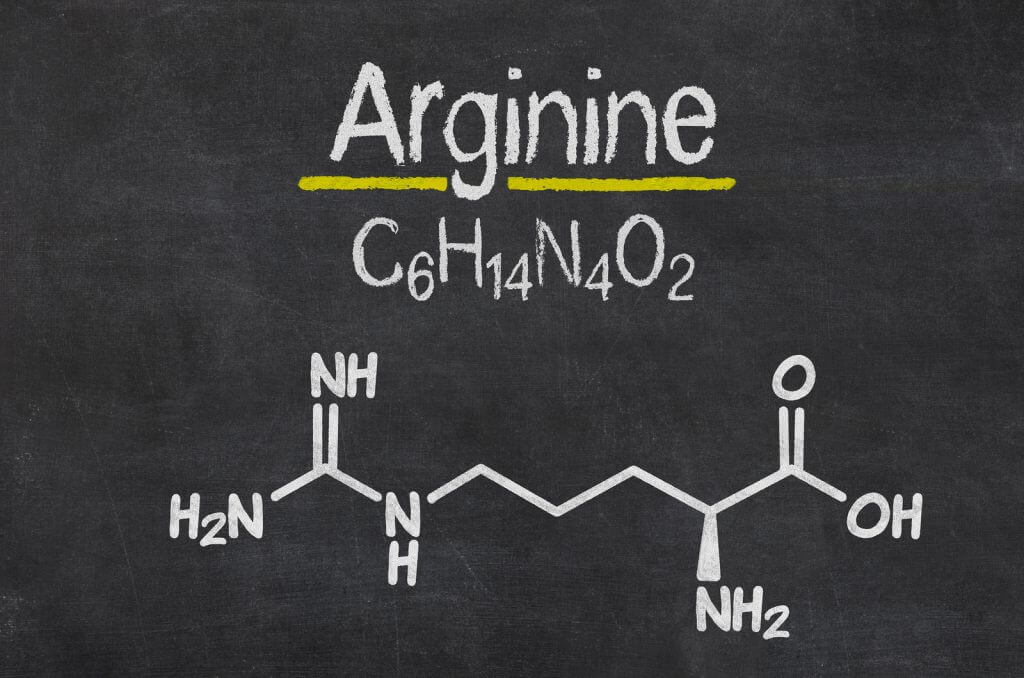
L-ARGININA
© Arginina to aminokwas, który jest wytwarzany w naszym organizmie z proliny i kwasu glutaminowego. Źródłem argininy w żywności są produkty takie jak: mięso, jaja, mleko, nasiona i orzechy. Nie należy jednak samodzielnie decydować o włączeniu suplementacji L-argininą, ponieważ nadmiar tego aminokwasu może mieć niekorzystny wpływ na stan zdrowia – bardzo ważna jest konsultacja z lekarzem prowadzącym [5].
© W grupie pacjentek suplementujących L-argininę zaobserwowano większy odsetek ciąż wśród kobiet z PCOS starających się o dziecko, a także zwiększoną aktywność receptorów estrogenowych w błonie śluzowej macicy [4].
Z czego to wynika?
Podsumowując, suplementacja L-argininą wpływa na:
- poprawę ukrwienia narządów rodnych,
- zwiększenie szansy na zagnieżdżenie zarodka w błonie śluzowej macicy (endometrium),
- prawidłowe dojrzewanie komórek jajowych i owulację,
- zwiększenie liczby owulacyjnych cykli miesiączkowych (L-arginina + N-acetylocysteina)
- obniżenie wskaźnika HOMA-IR (L-arginina + N-acetylocysteina).
Jednym zdaniem: tlenek azotu, powstały w wyniku przekształceń L-argininy, poprawia niektóre funkcje biologiczne, które są zaburzone w PCOS.
N-ACETYLOCYSTEINA (NAC)
NAC pozytywnie wpływa na gospodarkę węglowodanowo-insulinową [12]. Poprawia wrażliwość tkanek obwodowych na insulinę, obniża stężenie insuliny, a także przyczynia się do poprawy komórkowego metabolizmu glukozy, między innymi poprzez zwiększenie aktywności receptora dla insuliny.
© Wykazano, że suplementacja w dawce 1,6 g NAC obniżyła stężenie testosteronu we krwi, a także unormowała stężenie insuliny u kobiet z PCOS i towarzyszącą insulinoopornością [12].
© N-acetylocysteina ,,czuwa” nad prawidłowym dojrzewaniem komórek jajowych i ma korzystny wpływ na indukcję (zapoczątkowanie) owulacji u pacjentek z PCOS, szczególnie tych z insulinoopornością [13].
Podsumowując, NAC pozytywnie wpływa na:
- zmniejszenie stresu oksydacyjnego, który u kobiet z PCOS jest zwiększony,
- gospodarkę węglowodanowo-insulinową: poprawia wrażliwość tkanek na insulinę, obniża stężenie insuliny, poprawia komórkowy metabolizm glukozy
- obniżenie stężenia testosteronu we krwi,
- prawidłowe dojrzewanie komórek jajowych i indukcję owulacji w kobiet z PCOS, szczególnie z insulinoopornością.
WITAMINA D
W jaki sposób zbyt niskie stężenie witaminy D wpływa na przebieg cyklu miesiączkowego?

Dlaczego warto suplementować witaminę D przy PCOS i dbać o jej prawidłowe stężenie we krwi?
W jajnikach kalcitriol – aktywna forma witaminy D, pobudza wytwarzanie żeńskich hormonów płciowych, takich jak progesteron, estradiol i estron [15]. Co więcej prawidłowe stężenie witaminy D sprzyja uregulowaniu miesiączkowania i zwiększa występowanie spontanicznej owulacji u kobiet z PCOS [4].
Wykazano, że 12-tygodniowa suplementacja witaminy D przez kobiety z PCOS z towarzyszącym hiperandrogenizmem (nadmiernym stężeniem męskich hormonów płciowych, np. testosteron, androstendion, DHEA-S) ma korzystny wpływ na gospodarkę cukrową [4].
The Endocrine Practise Guidelines Committee sugeruje dzienną suplementację witaminą D w dawce na poziomie 1500-2000 IU dla osób dorosłych, w celu osiągnięcia stężenia 25(OH)D (kalcytriol- forma aktywna) w surowicy krwi >30 ng/ml. Ilość suplementowanej witaminy D należy dobrać na podstawie wyniku jej stężenia we krwi. W związku z tym najpierw należy wykonać badanie krwi, a następnie skonsultować się z lekarzem, który zadecyduje o dawce.
Podsumowując, niedobór witaminy D u kobiet z PCOS może powodować:
- zahamowanie dojrzewania pęcherzyków jajnikowych,
- nasilenie insulinooporności i objawów hirsutyzmu (nadmiernego owłosienia),
- zwiększoną produkcję testosteronu.
Podsumowując, prawidłowe stężenie witaminy D we krwi pozytywnie wpływa na:
- pobudzenie wytwarzania żeńskich hormonów płciowych, takich jak progesteron, estradiol i estron
- uregulowanie miesiączkowania i zwiększenie występowanie spontanicznej owulacji u kobiet z PCOS,
- uregulowanie glikemii (stężenia glukozy we krwi).
KWASY TŁUSZCZOWE OMEGA-3

Podsumowując, wzrost spożycia kwasów omega-3 z diety oraz ich suplementacja pozytywnie wpływają na:
- obniżenie stężenia testosteronu we krwi,
- uregulowanie cykli miesiączkowych,
- zmniejszenie stanu zapalnego w organizmie, który u kobiet z PCOS zazwyczaj jest przewlekle podwyższony,
- profil lipidowy: obniżenie stężenia cholesterolu całkowitego, frakcji LDL i trójglicerydów, a zwiększenie frakcji cholesterolu HDL,
- pracę i funkcjonowanie mózgu i układu nerwowego.
KWAS FOLIOWY
© Kwas foliowy jest bardzo ważnym elementem szlaku przemian homocysteiny – aminokwasu, którego nieprawidłowe wykorzystanie w organizmie może prowadzić do poważnych chorób i zaburzeń układu krążenia, których ryzyko jest zwiększone w PCOS. Należą do nich m.in. dyslipidemia, miażdżyca, nadciśnienie tętnicze, choroba niedokrwienna serca. Schorzenia te mogą prowadzić nawet do zawału serca czy udaru mózgu. Wykazano, że kobiety z PCOS mają wyższe stężenie homocysteiny we krwi w porównaniu do kobiet zdrowych [18]. Dlatego co najmniej raz w roku sprawdź jej stężenie.
© Niedobór kwas foliowego prowadzi do wzrostu stężenia homocysteiny – hiperhomocysteinemii, a przez to do wyżej wymienionych powikłań. Nadmiar homocysteiny ma negatywny wpływ nie tylko na układ krążenia, ale także na rozród i może prowadzić do powikłań w przebiegu ciąży, takich jak poronienie, a także zwiększa ryzyko zaburzeń rozwoju płodu [19].
© Co więcej, wysokie stężenie homocysteiny może zaburzać interakcję pomiędzy plemnikiem a komórką jajową, istotnie zmniejszając szansę na zapłodnienie i prawidłowe zagnieżdżenie zarodka [4].
© Dodatkowo niedobór kwasu foliowego może prowadzić do zaburzeń produkcji tzw. płodnego śluzu podczas owulacji.
© Z kolei odpowiednia podaż kwasu foliowego przyczynia się do wzrostu liczby dojrzewających pęcherzyków jajnikowych [4], a suplementacja kwasem foliowym w dawce 700 µg/dzień spowodowała zwiększenie liczby cykli owulacyjnych [20].
© Aby nie dopuścić do powikłań związanych z niedoborem kwasu foliowego, należy dostarczać go z dietą. Głównymi źródłami kwasu foliowego w diecie są: zielone warzywa (szpinak, sałata, brokuły, brukselka, zielony groszek, jarmuż), zwłaszcza liściaste, produkty zbożowe pełnoziarniste, ziarna i orzechy, produkty pochodzenia zwierzęcego (jaja, sery, wątróbka), drożdże. Warto skonsultować z lekarzem prowadzącym korzyści wynikające z suplementacji kwasu foliowego.

Jeśli planujesz ciążę lub jesteś w I. trymestrze, pamiętaj o suplementacji kwasu foliowego!
Polskie Towarzystwo Ginekologiczne zaleca, aby wszystkie kobiety starające się o dziecko rozpoczęły już 3 miesiące przed planowaną ciążą suplementację 400 µg kwasu foliowego (0,4 mg/dobę) i kontynuowały ją do końca pierwszego trymestru. Wykazano, że taka dawka kwasu foliowego chroni płód przed uszkodzeniami cewy nerwowej, z której między 2. a 4 .tygodniem ciąży rozwija się układ nerwowy dziecka (mózgowie i rdzeń kręgowy). Niedobór kwasu foliowego na tym etapie prowadzić może do bezmózgowia, rozszczepu kręgosłupa czy przepukliny [21]! Podczas gdy na tak wczesnym etapie wiele kobiet nie wie jeszcze, że jest w ciąży, u dziecka rozwija się jeden z najważniejszych układów w organizmie człowieka, jakim jest ośrodkowy układ nerwowy, dlatego szczególnie ważne jest zabezpieczenie się przed niedoborem tego składnika.
Podsumowując, niedobór kwasu foliowego może przyczyniać się do:
- wzrostu stężenia homocysteiny we krwi – homocysteinemii, która prowadzić do wielu poważnych chorób układu krążenia, a których ryzyko jest zwiększone przy PCOS,
- wystąpienia powikłań w przebiegu ciąży, np. poronienie,
- wzrostu ryzyka zaburzeń rozwoju płodu, wady cewy nerwowej: bezmózgowia, rozszczepu kręgosłupa, przepukliny,
- zmniejszenia szansy na zapłodnienie i zagnieżdżenie zarodka w ścianie macicy poprzez zaburzenie interakcji pomiędzy plemnikiem a komórką jajową,
- zaburzenia produkcji płodnego śluzu podczas owulacji.
Z kolei odpowiednia zawartość kwasu foliowego i suplementacja przyczyniają się do:
- zwiększenia liczby dojrzewających pęcherzyków jajnikowych,
- zwiększenia liczby cykli owulacyjnych.
Pamiętaj, aby jakąkolwiek suplementację konsultować ze swoim lekarzem jeszcze przed jej wprowadzeniem oraz o tym, że suplementy diety to tylko uzupełnienie terapii.
Kluczowe jest wprowadzenie zmian w stylu życia, takich jak odpowiedni sposób odżywiania, zwiększenie aktywności fizycznej, a także dbałość o dobrej jakości sen i regenerację.
Bardzo ważne jest prawidłowe dobranie suplementacji, która ma być tylko przysłowiową ,,wisienką na torcie”, tak aby poprawić, a nie pogorszyć stan zdrowia.
Piśmiennictwo:
- Larner J., D-chiro-inositol – its functional role in insulin action and its deficit in insulin resistance, Int J Exp Diabetes Res. 2002;3(1): 47-60.
- Kalra B. i wsp., The inositols and polycystic ovary syndrome, Indian J Endocrinol Metab. 2016 Sep-Oct; 20(5): 720-724.
- Unfer V. i wsp., Myo-inositol effects in women with PCOS: a meta-analysis of randomized controlled trials, Endocr Connect. 2017 Nov; 6(8): 647-658.
- Kostecka M., Zespół policystycznych jajników – rola diety i suplementacji we wspomaganiu leczenia, Polskie Towarzystwo Przyrodników 2018;4(321): 855-862.
- Narodowe Centrum Edukacji. Arginina – wszechstronny aminokwas
- Mahran A. i wsp., Nitric oxide donors improve the ovulation and pregnancy rates in anovulatory women with polycystic ovary syndrome treated with clomiphene citrate: A RCT, Int J Reprod Biomed. 2016 Jan; 14(1): 9-14.
- Meng C., Nitric oxide (NO) levels in patients with polycystic ovary syndrome (PCOS): a metaanalysis, J Int Med Res. 2019 Sep; 47(9): 4083-4094.
- Krishna M.B. i wsp., Impaired arginine metabolism coupled to a defective redox conduit contributes to low plasma nitric oxide in polycystic ovary syndrome, Cell Physiol Biochem 2017;43:1880–1892.
- Masha A. i wsp., Prolonged treatment with N-acetylcysteine and L-arginine restores gonadal function in patients with PCO syndrome, Endocrine Abstracts (2009)
- Mohammadi M., Oxidative stress and polycystic ovary syndrome: A brief review, Int J Prev Med. 2019; 10: 86.
- Kerksick C. i wsp., The antioxidant role of glutathione and N-acetyl-cysteine supplements and exercise-induced oxidative stress, J Int Soc Sports Nutr. 2005 Dec 9;2(2): 38-44.
- Fulghesu A. M., N-acetyl-cysteine treatment improved insulin sensitivity in women with polycystic ovary syndrome, Fertil Steril. 2002 Jun; 77(6): 1128-35.
- Thakker D. i wsp., N-Acetylcysteine for polycystic ovary syndrome: A systematic review and meta-analysis of randomized controlled clinical trials, Obstet Gynecol Int. 2015; 2015: 817849.
- Yildizhan R. i wsp., Serum 25-hydroxyvitamin D concentrations in obese and non-obese women with polycystic ovary syndrome, Arch Gynecol Obstet. 2009 Oct; 280(4): 559-63.
- Brzozowska M. i wsp., Rola niedoboru witaminy D w patofizjologii zaburzeń występujących w zespole policystycznych jajników, Ginekol Po. 2013, 84 456-460.
- Yang K.i wsp., Efectiveness of omega-3 fatty acid for polycystic ovary syndrome: a systematic review and meta-analysis, Reprod Biol Endocrinol. 2018; 16: 27.
- Dyall S. C., Long-chain omega-3 fatty acids and the brain: a review of the independent and shared effects of EPA, DPA and DHA, Front Aging Neurosci. 2015; 7:52.
- Maleedhu P. i wsp., Status of homocysteine in polycystic ovary syndrome (PCOS), J Clin Diagn Res. 2014 Feb; 8(2): 31-33.
- Sztenc S., Hyperhomocysteinemia and pregnancy complications, Ginekol Pol. 2004 Apr; 75(4): 317-25.
- Szczuko M. i wsp., Quantitative assessment of nutrition in patients with the polycystic ovary syndrome (PCOS), Rocz Panstw Zakl Hig 2016; 67(4): 419-426.
- Greenberg J. A i wsp., Folic acid supplementation and pregnancy: more than just neutral tube defect prevention, Rev Obstet Gynecol. 2011 Summer; 4(2): 52-59.

Najlepsze życzenia świąteczne!
Może Ci się spodobać

Sałatka z wędzonym łososiem i suszonymi pomidorami
8 listopada 2020
Ciasteczka a’la Pieguski
4 grudnia 2020

